Przewidywanie kształtów cząsteczek
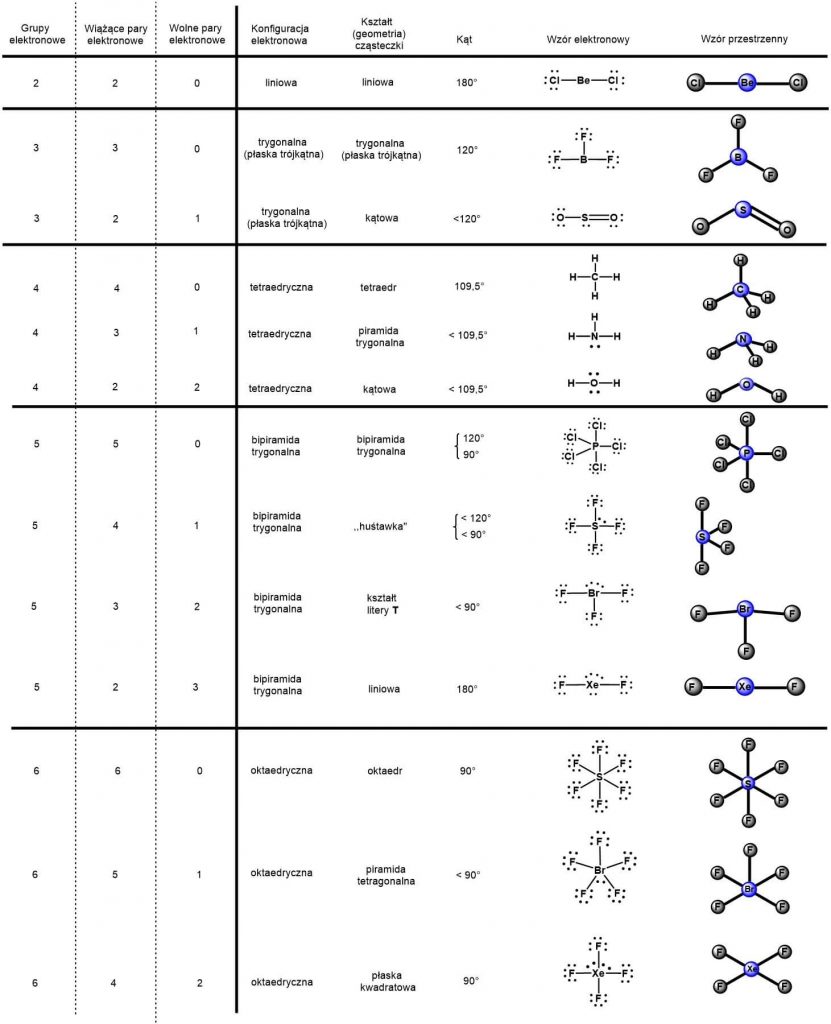
Metoda VSEPR (ang. Valence Shell Electron Pair Repulsion – odpychanie się elektronów powłoki walencyjnej) jest sposobem przewidywania kształtu kowalencyjnych cząsteczek pierwiastków grup głównych układu okresowego. Aby określić kształt cząsteczki musimy wyznaczyć liczbę przestrzenną (Lp), która jest suma wiążących par elektronowych (m) – wiązania typu ? jakie tworzy atom centralny i wolnych par elektronowych (n) atomu centralnego. Lp = n + m.
Liczbę wolnych par elektronowych atomu centralnego możemy wyznaczyć następująco:
n = ½ (V + C – O)
V – liczba elektronów walencyjnych atomu centralnego,
C – ładunek cząsteczki (ładunki dodatnie się odejmuje),
O – liczba elektronów brakujących do oktetu lub dubletu ligandów
| Cząsteczka | Ładunek (C) | Liczba wolnych par | Liczba wiązań ? | Lp |
| CO2 | 0 | n = ½ (4 – 0 – 4) | 2 | 2 |
| SO32− | ⎯2 | n = ½ (6 – (-2) – 6) | 3 | 4 |
| NH4+ | +1 | n = ½ (5 – 1 – 4) | 4 | 4 |
Określenie kształtu cząsteczki opiera się ona na bardzo prostych założeniach:
- Najsilniej odpychają się między sobą niewiążące pary elektronowe,
- Słabsze są oddziaływania niewiążących par elektronowych z elektronami wiązań chemicznych,
- Najsłabiej odpychają się pary elektronowe wiązań chemicznych.
Znając liczbę przestrzenną (grupy elektronowe) można określić kształt dowolnej cząsteczki.