Podsumowanie

Zadanie 1 (4 pkt)
Pierwiastek E leży w układzie okresowym w 4. grupie i 4. okresie.
| Podaj symbol tego pierwiastka i jego liczbę atomową. | |
| Napisz skróconą konfigurację elektronową atomu tego pierwiastka w stanie podstawowym | |
| Określ maksymalny stopień utlenienia tego pierwiastka w związkach | |
| Podaj zapis graficzny elektronów walencyjnych | |
| Określ liczbę elektronów niesparowanych | |
| Określ liczby kwantowe dla elektronów niesparowanych | |
| Określ liczbę całkowicie zajętych orbitali przez elektrony | |
| Podaj liczbę powłok elektronowych dla jonu dwudodatniego tego pierwiastka |

Zadanie 2 (2 pkt)
Większość związków metali bloku energetycznego d wykazuje silne zabarwienie. Własności te wiążą się z pochłanianiem kwantów światła przez atomy zawierające elektrony na niecałkowicie zapełnionych powłokach d. Jony zawierające wypełnioną elektronami podpowłokę d i nie zawierające elektronów d są bezbarwne. Podane jony wpisz w odpowiednie miejsca tabeli.
Ni2+, Mn2+, Cd2+, V2+, Cr2+, Fe2+, Ti4+, Sc3+, Cu+, Ti2+, V3+, Zn2+
| Jony barwne | Jony bezbarwne |

Zadanie 3 (3 pkt)
Podkreśl kation o następującej konfiguracji elektronowej:
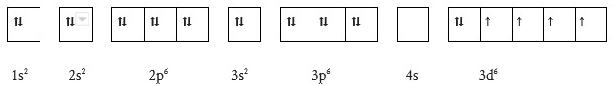
Kation: Co3+ Mn2+ Fe3+ Cr2+
Podaj liczby kwantowe opisujące elektrony niesparowane:
| Elektron | n | l | m | ms |
| 1) | ||||
| 2) | ||||
| 3) | ||||
| 4) |

Zadanie 4 (2 pkt)
Pewien pierwiastek jest mieszaniną dwóch izotopów, z których jeden o zawartości procentowej 54,8% – zawiera 44 neutrony w jądrze, zaś drugi 46 neutronów. Masa atomowa tego pierwiastka jest równa 79,904u. Liczba atomowa tego pierwiastka wynosi:
| Obliczenia: Liczba atomowa: |

Zadanie 5 (2 pkt)
Z podanych cząsteczek wybierz tę, która nie jest płaska:
| Cząsteczki: | SO3, AsH3, N2, CS2 |
| Wybór: |

Zadanie 6 (2 pkt)
Aktywność chemiczna litowców w obrębie grupy:
Wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
| Zdanie | P/F | |
| 1 | Wzrasta od litu do cezu | |
| 2 | Maleje od litu do cezu | |
| 3 | Osiąga maksymalna wartość dla potasu |

Zadanie 7 (1 pkt)
Rozpatrując wiązania w cząsteczkach H2 N2 Cl2 stwierdzamy, że (podkreśl właściwą odpowiedź):
a) liczba wiązań jest jednakowa
b) liczby wiązań są różne
c) w cząsteczkach N2 Cl2 liczba wiązań jest jednakowa
d) w cząsteczkach H2 Cl2 liczba wiązań jest jednakowa

Zadanie 8 (2 pkt)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeśli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
| Zdanie | P/F | |
| 1. | Atom magnezu ma mniejszy promień od atomu sodu | |
| 2. | Aktywność chemiczna cezu jest mniejsza od aktywności litu | |
| 3. | Tlenek strontu jest bardziej zasadowy od tlenku baru | |
| 4. | Sód jest lepszym reduktorem od potasu |

Zadanie 9 (1 pkt)
Podane tlenki uporządkuj według wzrastającego charakteru zasadowego:
Li2O, CO2, BeO, Cs2O, B2O3
……………………………………………………………………………………………………………………………….

Zadanie 10 (2 pkt)
Na podstawie informacji określ typ hybrydyzacji atomów centralnych w opisanych cząsteczkach. Uzupełnij tabelę.
| Wzór związku chemicznego | Informacja o budowie | Typ hybrydyzacji |
| CBr4 | Cząsteczka CCl4 ma kształt czworościanu foremnego. | |
| C2H4 | W cząsteczce C2H4 kąt między wiązaniami wynosi 120°. | |
| CH4 | W cząsteczce CH4 kąt między wiązaniami wynosi 109°28’. | |
| BeH2 | Kąt między wiązaniami w cząsteczce BeH2 wynosi 180°. | |
| C2H2 | Cząsteczka C2H2 ma budowę liniową. |

Zadanie 11 (2 pkt)
Atom pierwiastka X ma w sumie 6 elektronów walencyjnych na podpowłokach 3d i 4s. Wszystkie elektrony walencyjne tego pierwiastka są niesparowane. Podaj symbol tego pierwiastka i zapisz skróconą konfigurację elektronową tego pierwiastka.
Symbol pierwiastka:
……………………………………………………………………………………………………………………………….
Zapis skrócony konfiguracji:
……………………………………………………………………………………………………………………………….

Zadanie 12 (2 pkt)
Oceń prawdziwość poniższych zdań. Wstaw literę P- prawda lub literę F- fałsz w odpowiednie miejsca w tabeli.
| Prawda | Fałsz | |
| Wraz ze wzrostem liczby atomowej Z rośnie promień pierwiastków w grupach. | ||
| Wiązanie jonowe powstaje wówczas, gdy atomy różnią się znacznie elektroujemnością | ||
| Wzrost aktywności niemetali związany jest ze wzrostem promieni atomów tych pierwiastków | ||
| W jonie H3O+ orbitale walencyjne tlenu wykazują hybrydyzację sp3 | ||
| Cząsteczka SO3 jest polarna a cząsteczka SO2 niepolarna |

Zadanie 13 (2 pkt)
W atomie X, będącym w stanie podstawowym, trzy powłoki są całkowicie wypełnione a ostatnia podpowłoka zawiera 2 elektrony. Pierwiastek należy do bloku d
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeśli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
| Zdanie | P/F | |
| 1. | Liczba atomowa pierwiastka X jest równa 14 | |
| 2. | Liczba elektronów walencyjnych w atomie X wynosi 10 | |
| 3. | Pierwiastek X znajduje się w 12 grupie układu okresowego | |
| 4. | Pierwiastek X znajduje się w 3 okresie układu okresowego |

Zadanie 14 (2 pkt)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeśli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
| Zdanie | P/F | |
| 1. | Atom o konfiguracji powłoki walencyjnej 4s24p3 zawiera w rdzeniu atomowym 18 elektronów | |
| 2. | Jony Sc3+, K+, S2-, mają taką samą konfigurację elektronową | |
| 3. | Elektrony w jonach Sc3+, S2-, rozmieszczone są na podpowłokach 1s, 2s, 2p |

Zadanie 15 (3 pkt)
Pierwiastek E posiada 3 elektrony walencyjne, z których jeden w stanie podstawowym znajduje się na orbitalu opisanym liczbami kwantowymi n = 3, l = 1, m = -1, ms = 1/2.
Zidentyfikuj ten pierwiastek podając jego symbol i położenie w układzie okresowym
| Symbol pierwiastka | Nr grupy | Nr okresu | Blok konfiguracyjny |
Zapisz symbol helowca, którego konfigurację osiąga ten pierwiastek tworząc jon E3+
……………………………………………………………………………………………………………………………..
Ustal wzór sumaryczny tlenku i wodorku, w którym pierwiastek E występuje na swoim maksymalnym stopniu utlenienia.
| Wzór tlenku | Wzór wodorku |

Zadanie 16 (2 pkt)
Uzupełnij tabelę podając liczbę powłok elektronowych w podanych jonach:
| Na+ | Mn2+ | As3+ | S2- | Fe3+ | |
| Liczba powłok elektronowych |

Zadanie 17 (2 pkt)
Oceń prawdziwość poniższych zdań. Wstaw znak X w odpowiednie miejsca.
| Prawda | Fałsz | |
| Wraz ze wzrostem liczby atomowej Z rośnie charakter metaliczny pierwiastków chemicznych w okresach. | ||
| Wiązanie jonowe powstaje wówczas, gdy powstaje para elektronowa, która pochodzi tylko od jednego z atomów. | ||
| Na wiązanie wielokrotne między atomami składa się zawsze jedno wiązanie σ, a pozostałe to wiązania π. | ||
| Atom Na ma większy promień od jonu Na+ | ||
| Pierwsza energia jonizacji siarki jest większa od pierwszej energii jonizacji chloru |

Zadanie 18 (1 pkt)
Podkreśl cząsteczki lub jony, w których spełniony jest następujący warunek: występuje wiązanie koordynacyjne i cząsteczka lub jon ma budowę przestrzenną.
CH4, AlF3, SO3, H2O, NH4+, ClO4–

Zadanie 19 (3 pkt)
Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie:
· Jon prosty pierwiastka X posiada konfigurację Argonu
· elektrony walencyjne rozmieszczone są w dwóch powłokach elektronowych
· Liczba elektronów niesparowanych pierwiastka X jest o jeden mniejsza od liczby elektronów sparowanych
a) Uzupełnij poniższą tabelę. Wpisz symbol pierwiastka X, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego), do którego należy pierwiastek X.
| Symbol pierwiastka | Numer okresu | Numer grupy | Symbol bloku |
b) Napisz konfigurację elektronową atomu pierwiastka X (zapis skrócony z symbolem helowca).
……………………………………………………………………………………………………………………………….
c) Podaj zapis graficzny powłoki walencyjnej pierwiastka X
……………………………………………………………………………………………………………………………….

Zadanie 20 (1 pkt)
Paramagnetyzm to zjawisko polegające na porządkowaniu się większości spinów elektronów ciała zgodnie z liniami zewnętrznego pola magnetycznego. Właściwości paramagnetyczne posiadają substancje o niesparowanych elektronach.
Podkreśl wzory substancji będących paramagnetykami:
NO, Na, H2O, Al, He, Zn,

Zadanie 21 (3 pkt)
Dwa pierwiastki X i Y tworzą związek chemiczny, w którym mają konfigurację elektronową 1s22s22p6. Oba pierwiastki w stanie podstawowym mają po dwa elektrony niesparowane. Pierwiastek X w tym związku występuje na swoim maksymalnym stopniu utlenienia.
Napisz wzór sumaryczny związku, który opisano w informacji, a następnie podaj typ hybrydyzacji (sp, sp2, sp3) atomu pierwiastka X tworzącego opisany związek oraz określ budowę przestrzenną (liniowa, trójkątna, tetraedryczna) cząsteczki tego związku.
| Wzór sumaryczny | Typ hybrydyzacji | Budowa przestrzenna | Liczba wiązań typu σ: | Liczba wiązań typu π: |

Zadanie 22 (2 pkt)
Podaj dwa kationy i dwa aniony o konfiguracji elektronowej 1s22s22p63s23p6:
| Kationy | |
| Aniony |

Zadanie 23 (1 pkt)
Podane drobiny uporządkuj według wzrastającej liczby wiązań typu π:
H2O, O2, CO2,
………………………………………………………………..……………………………………………….

Zadanie 24 (3 pkt)
Pierwiastek X znajduje się w drugim okresie układu okresowego i tworzy następujące związki: X2O5, XH3. Uzupełnij tabelę:
| Symbol pierwiastka | Zapis pełny konfiguracji | Liczba elektronów niesparowanych | Liczba całkowicie zapełnionych powłok elektronowych |

Zadanie 24 (3 pkt)
Na podstawie budowy atomów pierwiastków uzupełnij poniższe zdania. Wybierz i podkreśl jedno z określeń podanych w nawiasie, tak aby powstało zdanie prawdziwe.
Jądro atomu azotowca ma ładunek (mniejszy /większy) niż jądro tlenowca.
Atom tlenu na promień (mniejszy /większy) niż atom siarki.
Glin jest (mniej / bardziej) aktywny od magnezu.

Zadanie 26 (2 pkt)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeśli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
| Zdanie | P/F | |
| 1. | W cząsteczce SiH4 atom krzemu występuje w stanie wzbudzonym | |
| 2. | W cząsteczce CO2 atom węgla ma hybrydyzację sp3 | |
| 3. | Cząsteczka SO3 ma budowę przestrzenną | |
| 4. | W związku o wzorze CS2 liczba wiązań ? jest równa liczbie wiązań ?. |

Zadanie 27 (2 pkt)
Pewien pierwiastek (E) tworzy tlenek typu E2O5, jego atom ma 4 powłoki elektronowe oraz spośród elektronów walencyjnych 3 należą do podpowłoki p.
Symbol pierwiastka: …………………………………………………………………………………………………………………
Wzór wodorku tworzonego przez ten pierwiastek …………………………………………………………………….

Zadanie 28 (3 pkt)
Podaj przykład dwu pierwiastków:
Czwartego okresu (bloku p) mających 1 elektron niesparowany: ………………………………………………………..
Trzeciego okresu mających 2 elektrony niesparowane na orbitalu p: ………………………………………………………..
Czwartego okresu tworzące jony proste o konfiguracji Ar: ………………………………………………………..