Podsumowanie

Informacje do zadań 1 – 3
Pierwiastek A konfiguracji [Kr] 5s¹ 4d¹⁰ tworzy z pierwiastkiem B o konfiguracji [He] 2s² 2p³ związek chemiczny typu AB3. Związek ten wykorzystywany jest jako materiał wybuchowy.
Zadanie 1 (2 pkt)
Uzupełnij tabelę: podaj symbole pierwiastków A i B oraz wzór związku chemicznego utworzonego przez te pierwiastki.
| Pierwiastek A | Pierwiastek B | Wzór sumaryczny związku |

Zadanie 2 (1 pkt)
Zapisz równanie reakcji zachodzącej w trakcie wybuchu opisanego związku wiedząc, że jednym z produktów jest gaz a drugim ciało stałe.
……………………………………………………………………………………………………………………………….

Zadanie 3 (1 pkt)
Oblicz jaką objętość zajmie wydzielony gaz w trakcje wybuchu jeśli materiał wybuchowy miał masę 10g a jego czystość wynosiła 90%. Objętość wydzielonego gazu zmierzono w temperaturze 270oC i pod ciśnieniem 2000hPa.
Rozwiązanie:
……………………………………………………………………………………………………………………………….
……………………………………………………………………………………………………………………………….

Zadanie 4 (2 pkt)
Na poniższym schemacie układu okresowego pierwiastków (bez lantanowców i aktynowców) zaznaczono położenie trzech pierwiastków oznaczonych numerami I, II oraz III.
| Informacja | P/F |
| Promień jonu X– pierwiastka II jest większy od promienia jonu pierwiastka III. | |
| Wodorek pierwiastka I ma budowę jonową a tlenek pierwiastka II budowę kowalencyjną. | |
| Kwasy tlenowe pierwiastków II i III na tym samym stopniu utlenienia maja taka samą moc. |

Zadanie 5 (3 pkt)
Uzupełnij tabelę:
| Symbol pierwiastka | Te |
| Blok energetyczny | |
| Zapis skrócony konfiguracji | |
| Liczba elektronów niesparowanych | |
| Wzór wodorku | |
| Wzór tlenku na najwyższym stopniu utlenienia | |
| Liczba powłok elektronowych jonu Te2- |

Zadanie 6 (2 pkt)
Przeanalizuj położenie berylu w układzie okresowym pierwiastków i oceń prawdziwość poniższych zdań. Wpisz do tabeli literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
| Numer | Zdanie | P/F |
| 1. | Beryl jest pierwiastkiem bloku p i w stanie podstawowym posiada dwa sparowane elektrony na podpowłoce 2p. | |
| 2. | Beryl jako jedyny pierwiastek w swojej grupie nie reaguje z wodą. | |
| 3. | Beryl jest pierwiastkiem o najniższej pierwszej energii jonizacji wśród pierwiastków grupy II |

Zadanie 7 (2 pkt)
Poniżej przedstawiono fragment uproszczonego układu okresowego pierwiastków.
Oceń prawdziwość poniższych informacji w odniesieniu do pierwiastków znajdujących się w tym fragmencie układu okresowego. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
| 1 | Energia powinowactwa elektronowego maleje zgodnie ze strzałką II | P | F |
| 2 | Promień atomu węgla jest większy od promienia atomu azotu | P | F |
| 3 | Promień jonu S2- jest mniejszy od promienia jonu Cl– | P | F |
| 4 | Energia powinowactwa elektronowego określa ilość energii wydzielanej w trakcje przyłączenia elektronu do obojętnego atomu. Jej wartość wzrasta zgodnie z kierunkiem strzałki I | P | F |

Zadanie 8 (1 pkt)
“Substancje o podobnej budowie rozpuszczają się w rozpuszczalnikach o podobnej do nich budowie”
Podkreśl cząsteczki substancji, które są rozpuszczalne w wodzie.
H2CO, SO3, NF3, CHCl3

Arsenowodór, AsH3 – nieorganiczny związek chemiczny, bezbarwny, piroforyczny, silnie trujący gaz o zapachu czosnku. Słabo rozpuszcza się w wodzie. Ogrzewany rozkłada się na arsen i wodór.
Arsenowodór – Wikipedia, wolna encyklopedia
Zadanie 9 (2 pkt)
Oceń prawdziwość poniższych zdań dotyczących arsenowodoru. Wpisz do tabeli literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
| Numer | Zdanie | P/F |
| 1. | Cząsteczka arsenowodoru jest polarna | |
| 2. | Pomiędzy cząsteczkami arsenowodoru mogą występować podobnie jak pomiędzy cząsteczkami wody wiązania wodorowe. | |
| 3. | Kąt pomiędzy wiązaniami w cząsteczce arsenowodoru wynosi 120o |

Zadanie 10 (1 pkt)
Arsenowodór powstaje w wyniku działania kwasami lub wodą na arsenki metali. Wiedząc, że arsen w arsenkach ma wartościowość III zapisz równanie reakcji otrzymywania arsenowodoru dodając do arsenku cynku kwasu siarkowego(VI).
………………………………………………………………………………………………………………

Wśród reakcji redoks można wyróżnić między innymi reakcję dysproporcjonowania, to taki przypadek reakcji redoks, w której jeden pierwiastek na pośrednim stopniu utlenienia tworzy dwa produkty, jeden na wyższym a drugi na niższym stopniu utlenienia Przykładem reakcji dysproporcjonowania jest ogrzewanie kwasu fosforowego(III), w której produktami jest gazowy produkt fosfina PH3 oraz kwas fosforowy(V).
Zadanie 11 (3 pkt)
Określ i wpisz do tabeli stopnie utlenienia wodoru, fosforu i tlenu we wszystkich reagentach reakcji dysproporcjonacji.
| Stopień utlenienia | w kwasie fosforowym (III) | w PH3 | w kwasie fosforowym (V) |
|---|---|---|---|
| wodoru | |||
| fosforu | |||
| tlenu |

Zadanie 12 (3 pkt)
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowoーelektronowy) równania procesów redukcji i utleniania zachodzących podczas opisanej reakcji dysproporcjonacji. Określ stosunek molowy kwasu fosforowego(III) do kwasu fosforowego (V) w tej reakcji.
Równanie procesu redukcji: …………….
Równanie procesu utleniania: ……………….
Stosunek molowy kwasu fosforowego(III) do kwasu fosforowego(V) = ……….

Zadanie 13 (2 pkt)
Oblicz objętość wydzielonego PH3 (w warunkach normalnych) powstałego z termicznego rozkładu 39,2 g kwasu fosforowego (III).
Rozwiązanie:
……………………………………………………………………………………………………………………………….
……………………………………………………………………………………………………………………………….

Wśród reakcji redoks można wyróżnić między innymi reakcję synproporcjonowania, w których dwa reagenty zawierające ten sam pierwiastek ale na innym stopniu utlenienia ulegają jednoczesnej przemianie do tego samego produktu. Przykładem reakcji synproporcjonowania jest reakcja biegnąca w akumulatorze ołowiowym pomiędzy ołowiem a tlenkiem PbO2 z dodatkiem kwasu siarkowego(VI).
Zadanie 14 (3 pkt)
Oblicz i wpisz do tabeli stopnie utlenienia ołowiu, tlenu i siarki we wszystkich substratach reakcji synproporcjonowania.
| Stopień utlenienia | w Pb | w PbO2 | w kwasie siarkowym(VI) |
|---|---|---|---|
| ołowiu | |||
| tlenu | |||
| siarki |

Zadanie 15 (3 pkt)
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo ー elektronowy) równania procesów redukcji i utleniania zachodzących podczas opisanej reakcji synproporcjonacji. Określ stosunek molowy ołowiu do kwasu siarkowego (VI) w tej reakcji.
Równanie procesu redukcji: ………………….
Równanie procesu utleniania: ………………..
Stosunek molowy ołowiu do kwasu siarkowego (VI) = …………..

Zadanie 16 (4 pkt)
Pewna reakcja przebiega zgodnie z ogólnym schematem:
Zn + NO3ー+ OHー ⟶ ZnO22ー+ NH3 + H2O
Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo ー elektronowy), równania procesów redukcji i utleniania zachodzących podczas tej przemiany.
Równanie procesu utleniania: ……………………
Równanie procesu redukcji: …………….
Dobierz i uzupełnij współczynniki stechiometryczne w reakcji sumarycznej
……………………………………………………………………………………………………………………………….
Napisz wzory drobin (cząsteczek lub jonów), które w opisanej przemianie pełnią funkcję utleniacza i reduktora.
Utleniacz: …………. Reduktor: ………………

Zadanie 17 (2 pkt)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeśli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
| Numer | Zdanie | P/F |
| 1. | Z analizy szeregu elektrochemicznego metali wynika, że kwasy nieutleniające reagują tylko z metalami o ujemnych potencjałach standardowych. | |
| 2. | W reakcji jodku potasu z woda bromową wydziela się osad, który po dodaniu chloroformu roztwarza się zabarwiając chloroform na fioletowo. | |
| 3. | Po dodaniu do zielonego roztworu zawierającego chlorek żelaza(II) nadtlenku wodoru obserwujemy zmianę barwy roztworu na kolor żółty. | |
| 4. | Charakter kwasowy tlenku krzemu(IV) możemy wykazać rozpuszczając go w wodzie z dodatkiem odpowiedniego wskaźnika. |

Zadanie 18 (2 pkt)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeśli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
| Numer | Zdanie | P/F |
| 1. | Jeden mol gazu w warunkach standardowych zajmuje objętość 22,4 dm3 | |
| 2. | W dwu molach cząsteczek kwasu siarkowego(VI) znajduje się więcej atomów niż 44.8 dm3 wodorku krzemu (warunki normalne) | |
| 3. | W 1 dm3 azotu znajduje się tyle samo atomów co w 1 dm3 tlenu (w tych samych warunkach ciśnienia i temperatury) |

Zadanie 19 (2 pkt)
Uzupełnij tabelę wpisując w odpowiednie miejsce P lub F.
| Po zmieszaniu 1 mola chlorku glinu z 6 molami wodorotlenku potasu w probówce wydzielił się biały osad | |
| Twardość przemijającą wody można usunąć w wyniku gotowania | |
| Wydzielenie osadu kwasu krzemowego z roztworu krzemianu potasu po dodaniu nasyconego roztworu dwutlenku węgla pozwala na wyciągnięcie wniosku związanego z mocą kwasu krzemowego i kwasu węglowego | |
| Podstawową reakcją otrzymywania wodorotlenków metali jest reakcji tlenku odpowiedniego metalu z wodą. |

Zadanie 20 (3 pkt)
Przeprowadzono następujące doświadczenie:
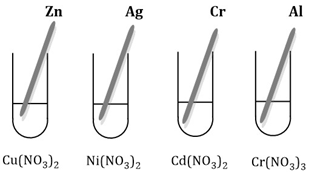
Jaki wniosek związany z aktywnością metali można wyciągnąć na podstawie doświadczenia zachodzącego w probówce I.
……………………………………………………………………………………………………………………………….
Jakie obserwacje można poczynić w probówce I.
……………………………………………………………………………………………………………………………….
……………………………………………………………………………………………………………………………….
Zapisz równanie reakcji w formie cząsteczkowej zachodzące w probówce 1.
……………………………………………………………………………………………………………………………….

Zadanie 21 (3 pkt)
Zapisz równania następujących reakcji:
| Redukcji tlenku krzemu(IV) węglem ………………………………………………………………………………………………………………………. |
| Redukcji siarczanu(VI) baru węglem wiedząc, że jednym z produktów będzie związek siarki, w którym siarka będzie występować na swoim minimalnym stopniu utlenienia. ……………………………………………………………………………………………………………………… |
| Redukcji tlenku żelaza(III) glinem ……………………………………………………………………………………………………………………….. |

Zadanie 22 (2 pkt)
Płytki cynkowe o tej samej masie zostały zanurzone w czterech różnych zlewkach A ーD zawierających różne roztwory wodne azotanów(V) kolejno:
- Cu(NO3)2
- Pb(NO3)2
- Mg(NO3)2
- AgNO3
Po pewnym czasie płytki wyjęto, a następnie osuszono i zważono.
Odpowiedz na pytania uzupełniając tabelę:
| Zlewki, w których nie stwierdzono zmiany masy płytek cynkowych: | |
| Zlewka, w której stwierdzono największy wzrost masy płytki cynkowej: | |
| Zlewka, w której stwierdzono zmniejszenie masy płytki cynkowej: |

Zadanie 23 (2 pkt)
Uzupełnij poniższe zdania dotyczące kryształów jonowych. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
Kryształy jonowe składają się z trójwymiarowego naprzemiennego ułożenia dodatnich i ujemnych jonów. Przykładem takiego kryształu jest (chlorku sodu / jod / diament).
Kryształy jonowe, ze względu na brak swobodnych elektronów są (złymi / dobrymi) przewodnikami elektryczności i ciepła.

Zadanie 24 (3 pkt)
Poniżej przedstawiono symbole kilku metali:
Bi, Sr, Be, Fe
Zapisz symbole podanych metali porządkując je według wzrastającej aktywności:
………………………………………………………………………………………………………………
Wpisz do tabeli symbole metali spełniające podane warunki:
| Metale reagujące z wodą | |
| Metale reagujące z kwasem solnym | |
| Metale reagujące z wodorotlenkiem sodu |

Zadanie 25 (3 pkt)
Poniżej podano wzory kilku popularnych gazów:
O2, Cl2, N2, CO2, NH3, HCl, H2S
Z podanego zbioru anionów wybierz te, które spełniają warunki podane w tabeli:
| Gazy a gęstości większej do gęstości powietrza: | |
| Gazy barwne: | |
| Gazy posiadające zapach: |

Zadanie 26 (2 pkt)
Cząsteczki pewnego związku zbudowane są z trzech pierwiastków: W wyniku spalenia 0,46g tego związku otrzymano 0,88g CO2 i 0,54g H2O. Ustal wzór empiryczny podanego związku.
Rozwiązanie:
……………………………………………………………………………………………………………………………….

Zadanie 27 (1 pkt)
Do wodnego roztworu chlorku cynku dodano w nadmiarze roztwór wodorotlenku potasu. Podaj wzór jonu, który będzie formą dominującą cynku w tym roztworze po przeprowadzeniu doświadczenia.
………………………………………………………………………………………………………………